Seguir a rota inata pode levar a imunoterapias celulares prontas para uso contra tumores sólidos
De acordo com a Sociedade Americana de Gene e Terapia Celular, a terapia celular é definida como "a administração de células inteiras vivas para o paciente para o tratamento de uma doença". Na oncologia, isso significou em grande parte a imunoterapia com células T, projetadas e não . Mas isso está mudando. À medida que a nossa compreensão do sistema imunológico inato alcança a nossa compreensão do sistema imunológico adaptativo, as células natural killer (NK) estão emergindo como uma alternativa às células T, provocando uma resposta imune aos tumores.
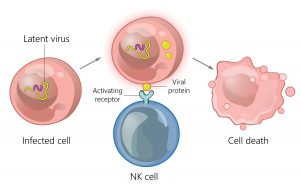
"As células T CAR demonstraram sucesso na leucemia porque as células tumorais e seus antígenos estão disponíveis no sangue", observa Robin Parihar, MD, PhD, professor assistente de hematologia-oncologia pediátrica no Baylor College of Medicine. "Toda terapia celular fica para trás em tumores sólidos, onde o antígeno está oculto."
E, é claro, os microambientes tumorais ao redor de tumores sólidos contêm células imunossupressoras, como células supressoras derivadas de mielóides, macrófagos inibidores e células T reguladoras (Tregs) que conspiram para inibir a atividade das células T - incluindo quaisquer células T CAR que os médicos possam querer use para destruir o tumor.
O laboratório de Parihar está "tentando encontrar as modificações certas para fazer nas células NK", diz ele. A idéia é transformar microambientes de tumores frios em quentes, ou seja, aliviar a imunossupressão endógena, para que as terapias com células T CAR possam fazer seu trabalho.
"Demorou um pouco para descobrir como projetar células NK fora do corpo", lamenta ele, mas seu laboratório encontrou uma maneira de produzir células CAR NK, células NK que expressam uma proteína quimérica que consiste em dois componentes ligados: a ativação NKG2D e a cadeia cy citotóxica do receptor de células T. Essas células NKG2D. targeted direcionaram e mataram células supressoras derivadas de mielóides imunossupressores em microambientes tumorais xenoenxertados e em estudos de cultura de tecidos com células de neuroblastoma humano.
Ao contrário das estratégias anteriores usadas nas tentativas de submodular as células supressoras derivadas de mielóides no microambiente tumoral, essas células NKG2D.ζ não apresentam toxicidade fora do alvo e continuam a aliviar a imunossupressão muito depois de serem administradas pela primeira vez - cerca de duas semanas no laboratório. As células NKG2D.ζ podem fazer mais do que aumentar a eficácia das células T CAR entregues aos tumores. Eles podem ajudar a recrutar as células T CAR para os tumores.
Uma nova classe de biomarcador
Amir Horowitz, PhD, professor assistente de ciências oncológicas da Escola de Medicina Icahn no Monte Sinai, estuda células NK através das lentes das moléculas do antígeno leucocitário humano (HLA) que as "educam". Os genes HLA são os mais polimórficos do nosso genoma e há muito se sabe que estimulam as células T CD8 + . O fato de que eles também regulam a função das células NK não foi tão apreciado. Talvez, diz Horowitz, seja porque “as células NK fazem parte da imunidade inata, não da imunidade adaptativa. Eles não requerem sensibilização prévia. Mas na medula óssea, eles aprendem como é a expressão saudável do HLA1. ”
Ele usou citometria de massa para reclassificar alelos HLA, definindo novas categorias de pacientes com câncer. Aqueles com menor HLA-E em seu microambiente tumoral não educam fortemente as células NK através do NKG2A. Eles têm um microambiente de tumor quente e estão maduros para tratamento com inibidores de ponto de verificação PD-1 e outras imunoterapias. Aqueles com maior HLA-E, em contraste, têm um microambiente mais imunossupressor com muito menos infiltração de células NK. Isso pode explicar por que apenas 10 a 20% dos pacientes responderam inicialmente ao bloqueio do ponto de verificação de PD-1. Reclassificar as moléculas de HLA dessa maneira pode permitir que elas sejam usadas como biomarcadores para "compartimentar as pessoas para quem se beneficiará mais das terapias disponíveis no mercado", sugere Horowitz. "É um medicamento personalizado, mas não tão específico - ou demorado - quanto as células T CAR".
Tocando na base e seguindo em frente
"Os fatores que impulsionam o desenvolvimento das células NK humanas são pouco compreendidos, especialmente em comparação com as células T e B, porque seu desenvolvimento é muito menos restrito aos tecidos", aponta Emily M. Mace, PhD, professora assistente de pediatria na Universidade de Columbia. Um de seus objetivos de pesquisa é definir a natureza dos contatos célula-célula e o papel da migração celular na formação da maturação funcional das células NK.
Idealmente, entender os fatores dependentes de contato que promovem o desenvolvimento das células NK informará melhor o desenho da imunoterapia racional baseada em células NK. Seu trabalho mostrou que as células NK se tornam cada vez mais móveis à medida que progridem nos estágios de maturação, e que essa progressão depende da formação de uma "sinapse de desenvolvimento" entre as células NK e as células estromais de suporte. No entanto, ela alertou que “existem diferenças muito pertinentes entre ratos e pessoas com imunidade inata que dificultam as comparações. Como o sistema imunológico inato é moldado por seu ambiente - o microbioma, exposições virais -, os resultados de estudos realizados em camundongos livres de germes podem não ser os aplicáveis a pessoas e doenças humanas. ”
Produzindo grandes doses com eficiência
Robert Igarashi, PhD, co-fundador e CSO da CytoSen Therapeutics, diz que sua empresa proclama sua abordagem em seu slogan - Na guerra contra o câncer, os números são importantes. ™ Segundo ele, o principal componente necessário para transformar células NK em uma terapia viável está gerando e mantendo a dose adequada, que precisa ser bastante alta. “Adultos normais têm de um a dois bilhões de células NK circulantes. Dose 10 vezes isso ”, ressalta. O método CytoSen expande as células NK, estimulando-as com IL-21, que produz uma expansão maior e mais rápida do que os métodos anteriores, além de células mais potentes. Cada célula NK - e lembre-se, existem muitas - possui mais capacidade de matar tumores.
O CytoSen usa IL-21 ligada a nanopartículas proprietárias para estimular suas células NK em vez de células alimentadoras, uma vez que as células alimentadoras são uma responsabilidade comercial. Constituindo material vivo derivado de tumor, as células alimentadoras representam um risco de contaminação. "Nossas nanopartículas ligadas à IL-21 são inseridas em preparações limpas de membranas biológicas, juntamente com proteínas extracelulares", explica Igarashi.
"Esta é uma nova maneira de ativar as células NK (e possivelmente outras)", continua ele. “Parece uma membrana celular para as células NK, mas evita os riscos das células alimentadoras. É mais seguro, cumpre os regulamentos da Europa e é mais econômico e logisticamente superior, pois não requer galões de meios de cultura de células. As nanopartículas podem ser facilmente armazenadas até serem necessárias. Nós quebramos a porca de fabricação. ”
Terapia NK como o "mais próximo"
Durante seu pós-doutorado no início dos anos 90, Lawrence Lamb, PhD, CSO da Incysus Therapeutics, observou que cerca de um quarto dos pacientes com leucemia apresentavam níveis elevados de células T γδ após receberem transplantes de medula óssea sem células T αβ. "Esses pacientes estavam sobrevivendo em uma proporção incomum após o transplante de medula óssea", diz ele.
Lamb passou sua carreira acompanhando essa observação inicial, demonstrando que as células T γδ poderiam matar as linhas celulares de leucemia no laboratório. Mas eles eram raros e difíceis de trabalhar. Demorou cerca de 10 anos para descobrir como expandir as células in vitro para que pudessem ser fabricadas em escala e usadas na clínica.
“As células T γδ e as células NK fazem as mesmas coisas”, explica Lamb. “Uma vantagem das células T γδ é que elas não possuem o principal requisito de reconhecimento de complexos de histocompatibilidade, para que possam reconhecer coisas que uma célula NK não pode. Eles também têm um repertório diferente de receptores ativadores e supressores, portanto provavelmente serão apropriados em ambientes diferentes das células NK. ”A Incysus criou células T γδ que são protegidas do agente quimioterapêutico temozolomida (Temodar) e, portanto, podem ser usado em conjunto com ele. A quimioterapia torna o microambiente do tumor mais suscetível às células T γδ, que recrutam outras células imunes inatas para atacar ainda mais o tumor. O Incysus tentará testar este sistema para uso em pacientes com glioblastoma ainda este ano. Por fim, Lamb prevê que as células T γδ sejam usadas como terapia de fechamento - não para substituir as células T CAR, mas para serem administradas como "aumento do sistema imunológico" para erradicar completamente a doença depois que ela se tornou indetectável por outros tratamentos.
Fonte: Genengnews
As informações e sugestões contidas neste blog são meramente informativas e não devem substituir consultas com médicos especialistas.
É muito importante (sempre) procurar mais informações sobre os assuntos.

Nenhum comentário:
Postar um comentário